Normal
0
false
false
false
IN
X-NONE
X-NONE
/* Style Definitions */
table.MsoNormalTable
{mso-style-name:”Table Normal”;
mso-tstyle-rowband-size:0;
mso-tstyle-colband-size:0;
mso-style-noshow:yes;
mso-style-priority:99;
mso-style-parent:””;
mso-padding-alt:0cm 5.4pt 0cm 5.4pt;
mso-para-margin-top:0cm;
mso-para-margin-right:0cm;
mso-para-margin-bottom:10.0pt;
mso-para-margin-left:0cm;
line-height:115%;
mso-pagination:widow-orphan;
font-size:11.0pt;
font-family:”Calibri”,”sans-serif”;
mso-ascii-font-family:Calibri;
mso-ascii-theme-font:minor-latin;
mso-hansi-font-family:Calibri;
mso-hansi-theme-font:minor-latin;
mso-bidi-font-family:”Times New Roman”;
mso-bidi-theme-font:minor-bidi;
mso-fareast-language:EN-US;}
table.MsoTableGrid
{mso-style-name:”Table Grid”;
mso-tstyle-rowband-size:0;
mso-tstyle-colband-size:0;
mso-style-priority:59;
mso-style-unhide:no;
border:solid windowtext 1.0pt;
mso-border-alt:solid windowtext .5pt;
mso-padding-alt:0cm 5.4pt 0cm 5.4pt;
mso-border-insideh:.5pt solid windowtext;
mso-border-insidev:.5pt solid windowtext;
mso-para-margin:0cm;
mso-para-margin-bottom:.0001pt;
mso-pagination:widow-orphan;
font-size:11.0pt;
font-family:”Calibri”,”sans-serif”;
mso-ascii-font-family:Calibri;
mso-ascii-theme-font:minor-latin;
mso-hansi-font-family:Calibri;
mso-hansi-theme-font:minor-latin;
mso-bidi-font-family:”Times New Roman”;
mso-bidi-theme-font:minor-bidi;
mso-fareast-language:EN-US;}
Bagaimana Kekuatan Van Der Waals Menyatukan Molekul – Gaya antarmolekul adalah gaya interaktif yang bekerja di antara molekul-molekul tetangga. Ada beberapa jenis gaya antarmolekul seperti interaksi ion-dipol yang kuat, interaksi dipol-dipol, interaksi dispersi London atau ikatan dipol yang diinduksi. Di antara gaya-gaya antarmolekul ini, gaya dispersi London dan gaya dipol-dipol termasuk dalam kategori gaya Van Der Waals.
Pengertian Interaksi Dipol-Dipol
Ketika dua atom dari elektronegativitas yang berbeda berbagi sepasang elektron, atom yang lebih elektronegatif menarik pasangan elektron ke arahnya sendiri. Oleh karena itu, ia menjadi sedikit negatif (δ-), menginduksi muatan yang sedikit positif (δ +) pada atom yang kurang elektronegatif. Agar ini terjadi, perbedaan keelektronegatifan antara dua atom harus> 0,4. Contoh khas diberikan di bawah ini:
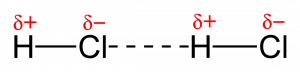
Cl lebih elektronegatif daripada H (perbedaan keelektronegatifan 1,5). Oleh karena itu, pasangan elektron lebih condong ke arah Cl dan menjadi δ-. Ujung molekul ini menarik ujung + molekul lain, membentuk ikatan elektrostatik di antara keduanya. Ikatan semacam ini disebut ikatan dipol-dipol. Ikatan ini adalah hasil dari awan listrik asimetris di sekitar molekul.
Ikatan hidrogen adalah jenis khusus ikatan dipol-dipol. Agar terjadi ikatan hidrogen, harus ada atom yang sangat elektronegatif yang melekat pada atom hidrogen. Kemudian pasangan elektron yang dibagi akan ditarik ke arah atom yang lebih elektronegatif. Seharusnya ada molekul tetangga dengan atom yang sangat elektronegatif yang memiliki pasangan elektron bebas di atasnya. Ini disebut akseptor hidrogen yang menerima elektron dari donor hidrogen.
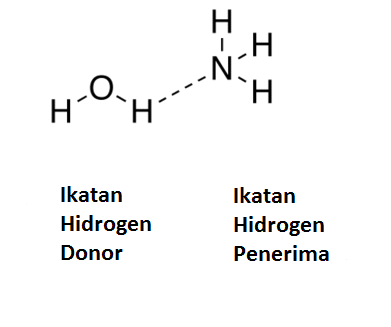
Dalam contoh di atas, atom oksigen dari molekul air berperilaku sebagai donor hidrogen. Atom nitrogen dari molekul amonia adalah akseptor hidrogen. Atom oksigen dalam molekul air menyumbangkan hidrogen ke molekul amonia dan membuat ikatan dipol dengannya. Jenis ikatan ini disebut ikatan hidrogen.
Pengertian Gaya Dispersi London
Gaya dispersi London sebagian besar terkait dengan molekul non-polar. Ini berarti bahwa atom yang berpartisipasi dalam pembentukan molekul memiliki elektronegativitas yang sama. Karenanya, tidak ada muatan yang terbentuk pada atom.
Alasan dispersi London adalah pergerakan acak elektron dalam molekul. Elektron dapat ditemukan di setiap ujung molekul kapan saja, menjadikannya end-. Ini membuat ujung molekul lain δ +. Penampilan dipol dalam molekul ini dapat menginduksi dipol dalam molekul lain juga.
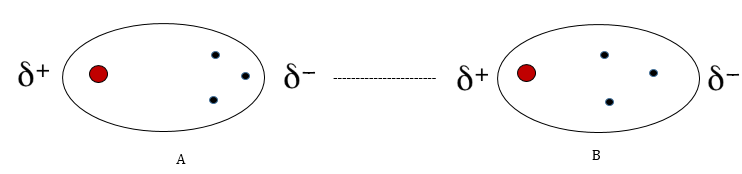
Gambar di atas menunjukkan bahwa δ-ujung molekul di sebelah kiri mengusir elektron dari molekul terdekat karenanya, mendorong sedikit kepositifan pada ujung molekul. Hal ini menyebabkan ketertarikan antara ujung bermuatan dua molekul yang berlawanan. Jenis obligasi ini disebut obligasi dispersi London. Ini dianggap sebagai jenis interaksi molekul terlemah dan mungkin bersifat sementara. Solvasi molekul non-polar dalam pelarut non-polar disebabkan oleh adanya ikatan dispersi London.
Bagaimana Kekuatan Van Der Waals Menyatukan Molekul
Gaya Van Der Waals yang disebutkan di atas dianggap agak lebih lemah daripada gaya ionik. Ikatan hidrogen dianggap jauh lebih kuat daripada kekuatan Van Der Waals lainnya. Gaya dispersi London adalah tipe terlemah dari pasukan Van Der Waals. Pasukan dispersi London sering hadir dalam halogen atau gas mulia. Molekul bebas mengapung karena kekuatan yang menyatukannya tidak kuat. Ini membuat mereka mengambil volume yang besar.
Interaksi dipol-dipol lebih kuat daripada gaya dispersi London dan sering hadir dalam cairan. Zat yang memiliki molekul yang disimpan bersama oleh interaksi dipol dianggap polar. Zat polar hanya bisa dilarutkan dalam pelarut polar lain.
Tabel berikut membandingkan dan membedakan dua jenis pasukan Van Der Waals.
|
Interaksi Dipol-Dipol |
Gaya dispersi London |
|
Dibentuk antara molekul-molekul dengan atom-atom yang memiliki perbedaan elektronegativitas luas (0,4) |
Dipol diinduksi dalam molekul dengan distribusi asimetris dari elektron yang bergerak secara acak. |
|
Jauh lebih kuat secara komparatif dan energi |
Relatif lebih lemah dan mungkin sementara |
|
Hadir dalam zat kutub |
Hadir dalam zat non-kutub |
|
Air, p-nitrofenil, etil alkohol |
Halogen (Cl 2, F 2 ), gas mulia (He, Ar) |
Namun, kekuatan Van Der Waals lebih lemah dibandingkan dengan ikatan ionik dan kovalen. Jadi tidak perlu banyak pasokan energi untuk dipatahkan.
