Apakah Anda tahu panjang ikatan kimia?
Apakah Anda akan terkejut jika saya memberi tahu Anda bahwa dua bola tenis yang diikatkan pada karet gelang adalah contoh yang bagus dari ikatan kimia antar atom? Mari saya tunjukkan apa yang saya maksud.
|
|
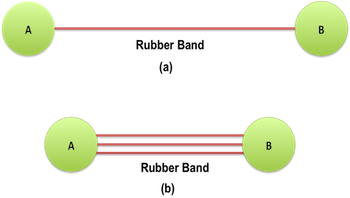
Katakanlah Anda menggunakan karet gelang dan menghubungkannya ke setiap bola tenis, lalu coba pisahkan bola-bola tersebut, seperti pada gambar (a). Panjang karet gelang itu akan banyak melar dan akhirnya putus.
Misalkan Anda mengambil tiga karet gelang dan memasangnya ke setiap bola tenis. Sekarang, coba pisahkan, seperti pada gambar (b). Tidak hanya dibutuhkan lebih banyak tenaga untuk menarik bola tenis itu, tetapi panjang karet gelang juga tidak terlalu meregang. Lebih penting lagi, panjang yang diperpendek ini membantu mencegah pita elastis putus.
Panjang ikatan adalah jarak terukur antara atom-atom yang berikatan kovalen. Ukuran panjang tautan, atau jarak, adalah rata-rata. Kembali ke contoh bola tenis dan karet gelang, kita dapat melihat mengapa jarak dianggap rata-rata. Bola tenis yang diikatkan pada karet gelang dapat melompat mundur dengan kecepatan sangat tinggi setelah dipisahkan. Padahal, bola tenis yang dipasang pada tiga karet gelang membutuhkan waktu lebih lama untuk pulih. Dalam kaitannya dengan kimia, atom tidak statis atau diam. Mereka bisa memantul atau bergerak saat terpasang. Panas dan jumlah ikatan yang ada (ikatan tunggal, rangkap dua, atau rangkap tiga) dapat mempengaruhi pergerakan ini. Namun, pada titik tertentu, kesetimbangan akan terbentuk di mana atom akan tetap diam. Pada saat inilah pengukuran panjang tautan (rata-rata) dilakukan. Membiarkan’
Hukum Coulomb dan panjang ikatan
Jika kita berpikir tentang ikatan kovalen yang terbentuk antara dua atom, ada tingkat gaya tarik-menarik tertentu yang memfasilitasi ikatan ini. Gaya tarik-menarik ini berkontribusi pada panjang ikatan melalui prinsip yang disebut hukum Coulomb. Hukum Coulomb secara matematis menggambarkan kekuatan gaya ini yang digunakan untuk menyatukan dua atom bermuatan berlawanan. Dalam hal ini, pikirkan tentang hubungan antara gaya dan energi: yaitu, jumlah gaya (atau energi yang dibutuhkan) untuk menyatukan atom-atom. Persamaan hukum Coulomb ditunjukkan pada Persamaan 1.
Persamaan 1: Hukum Coulomb
F e = ke ( Q1 * Q2 ) / r 2
Sekarang saya tahu Anda mungkin berpikir, ‘Apa hubungan muatan dengan ikatan kovalen?’ Selalu ingat bahwa semua jenis ikatan, baik kovalen atau ionik, memerlukan daya tarik elektrostatik agar atom dapat berikatan satu sama lain. Ketika Anda melihat kata elektrostatika, pikirkan tentang muatan berlawanan yang saling tarik-menarik. Menerapkan konsep ini pada ikatan kovalen, atom yang memiliki keelektronegatifan tinggi (yang suka berbagi elektron) akan dengan mudah berpartisipasi dalam jenis ikatan ini. Daya tarik elektrostatik antara inti bermuatan positif dari satu atom dan elektronegativitas tinggi dari atom lain mengikat kedua atom bersama-sama seperti magnet. Mereka meluncur melewati satu sama lain karena, seperti yang kita semua tahu, berlawanan menarik.
Oleh karena itu, dengan menggunakan versi hukum Coulomb yang dimodifikasi seperti yang ditunjukkan pada Persamaan 2, kita dapat menetapkan hubungan antara energi gaya tarik ini dan panjang ikatan. Ingatlah selalu hal ini: semakin besar jarak (panjang tautan), semakin sedikit energi yang dibutuhkan untuk memutus tautan (dan sebaliknya). Saya harap Anda tidak bosan dengan contoh bola tenis, tapi mari kita gunakan sekali lagi.
Persamaan 2: Modifikasi Hukum Coulomb
E = ( k * Q1 * Q2 ) / r
Bayangkan seperti ini: semakin panjang jarak antara kedua bola tenis tersebut (karena peregangannya), semakin sedikit energi yang dibutuhkan untuk mematahkan karet gelang menjadi dua. Konsep yang sama berlaku jika Anda memutuskan untuk mengurangi panjangnya dengan tidak meregangkan bola tenis terlalu banyak. Butuh lebih banyak energi untuk mematahkan karet gelang. Untungnya, kami tidak peduli dengan menghitung panjang tautan menggunakan kekuatan tautan. Ada cara yang lebih mudah untuk menentukan panjang tautan.
Cara Menghitung Panjang Ikatan
Ada tiga langkah sederhana yang dapat diikuti untuk menghitung panjang tautan:
- Gambarkan struktur Lewis dari molekul tersebut.
- Gunakan tabel untuk mengidentifikasi jari-jari setiap atom terikat dalam molekul.
- Tambahkan dua nilai jari-jari
Panjang ikatan umumnya diukur dalam angstrom atau pikometer. Ada grafik yang mengungkapkan perkiraan panjang ikatan (jari-jari dalam angstrom atau pikometer) antara dua atom yang diberikan, berdasarkan jenis ikatan (yaitu ikatan tunggal, rangkap dua, atau rangkap tiga). Mari kita lihat contohnya:
Misalkan Anda mencoba untuk menentukan panjang ikatan hidrogen dan klorin dalam molekul asam klorida (HCl):
Langkah 1: Gambarkan struktur Lewis dari HCl
|
|
Langkah 2: Tentukan jari-jari setiap atom berikatan (menggunakan tabel panjang ikatan)
H: 31 pikometer
Cl: 102 pikometer
Langkah 3: Tambahkan jari-jari total
HCl = 31 + 102 = 133 pikometer
Ini memberitahu Anda bahwa panjang ikatan antara hidrogen dan klorin, dalam satu molekul HCL, adalah 133 pikometer. Itu tidak terlalu buruk, bukan? Terus berlatih cara menghitung panjang link. Ingatlah bahwa panjang ikatan memainkan peran penting dalam energi dan kekuatan ikatan kimia.
Ringkasan Pelajaran
Panjang ikatan adalah jarak terukur antara dua atom yang berikatan kovalen. Jarak terukur ini adalah rata-rata, karena jarak antar atom yang berikatan dapat berubah. Gaya elektrostatik, di mana lawan menarik, berkontribusi pada kekuatan ikatan. Rumus hukum Coulomb yang dimodifikasi menjelaskan hubungan antara energi ikatan (kekuatan) dan panjang ikatan. Semakin besar panjang ikatan, semakin sedikit energi yang dibutuhkan untuk memutuskan ikatan tersebut. Semakin pendek panjang ikatan, semakin banyak energi yang dibutuhkan untuk memutuskan ikatan.
Tiga langkah dapat digunakan untuk menentukan panjang sambungan:
(1) Menggambar struktur Lewis
(2) Penentuan jari-jari (pikometer) untuk setiap atom berikatan
(3) Jumlah jari-jari total